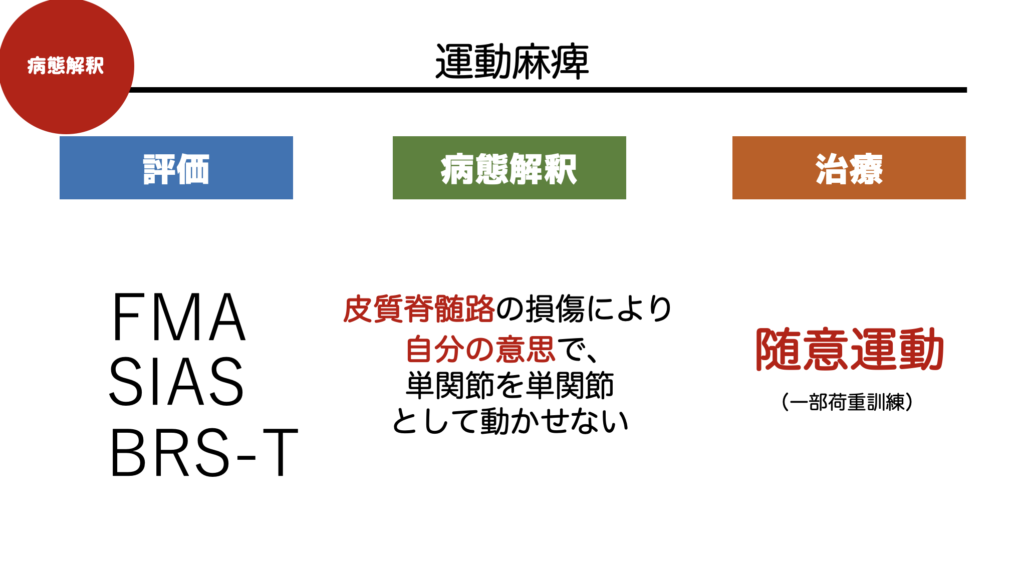
皮質脊髄路(Corticospinal Tract)は、脳の運動機能の中枢である大脳皮質から脊髄の運動ニューロンへと至る主要な神経経路であり、随意運動、特に四肢の精密な運動制御において極めて重要な役割を果たしています。本記事では、皮質脊髄路の解剖学的構造と神経生理学的機能を詳細に解説し、臨床的な意義や機能回復のメカニズムについても触れます。
解剖学的構造
- 起始点: 皮質脊髄路は主に大脳皮質の一次運動野(ブロードマン領域4)から始まりますが、補足運動野や前運動野など、他の運動関連領域からも神経線維が出ています【Galea & Darian-Smith, 1997】。
- 経路: 神経線維は大脳の内包を通過し、脳幹の中脳、橋、延髄を下行します。
延髄の下部にある錐体交叉で、約80-90%の線維が反対側に交叉し、外側皮質脊髄路(lateral corticospinal tract)として脊髄を下行します。残りの10-20%の線維は交叉せず、同側の前皮質脊髄路(anterior corticospinal tract)として下行します【Lemon, 2008】。これが機能回復に関わる重要な知識ですので、しっかりと押さえておきましょう。
この交叉によって、左半球の大脳皮質が右側の身体を、右半球の大脳皮質が左側の身体を制御することになります。 - 外側皮質脊髄路: 錐体交叉後に反対側の脊髄外側索を通り、主に四肢の随意運動を制御します。この経路は、特に手指の細かい運動に重要です。
• 前皮質脊髄路: 交叉せずに同側の脊髄前索を下行し、体幹や近位筋の運動制御に関与します。
神経生理学的機能
皮質脊髄路は、運動ニューロンに直接信号を送ることで筋肉の収縮を制御します。この神経経路は、細かく調整された運動、例えば手や指の精密な動きにおいて重要な役割を果たし、また運動の強さやタイミングを調整する機能も持っています。
• 一次運動野からの信号伝達: 一次運動野から発せられた信号が、皮質脊髄路を通じて脊髄に伝達され、運動ニューロンを介して筋肉に伝わり、具体的な運動が実行されます。
これにより、精緻な随意運動が可能になります。
• 神経可塑性: 脳卒中や脊髄損傷後、皮質脊髄路の損傷により運動機能が著しく低下しますが、リハビリテーションを通じて他の神経経路が代償的に機能を引き継ぐことで、運動機能の回復が可能です。
このプロセスは神経可塑性(neural plasticity)と呼ばれ、脳の回復力と適応力を示すものです【Nudo, 2013】。

臨床的意義と損傷後の機能回復
皮質脊髄路損傷の臨床的意義
皮質脊髄路の損傷は、運動機能の喪失や低下を引き起こします。特に、四肢の精細な動きが困難になり、麻痺や筋力低下が現れます。
損傷の程度や部位により、症状の重症度は異なりますが、片側に現れる麻痺(片麻痺)や筋肉が勝手にこわばってしまう(痙性、痙縮、Spasticity)がしばしば観察されます。
これらの症状は、患者の生活の質に大きな影響を与えるため、早期の評価と適切なリハビリテーションが必要です。
機能回復のメカニズム
機能回復には、以下のメカニズムが関与します
• 神経可塑性: 神経可塑性により、脳の未損傷領域が新たな神経経路を形成し、失われた機能を代償することが可能です。特に運動イメージトレーニングや挑戦的な課題を行うことが、この神経可塑性を促進することが示されています【Taub et al., 2006】。

• 未交叉線維の再利用: 前皮質脊髄路などの未交叉線維が、損傷後に新たな運動経路として利用されることがあります。これにより、残存機能を最大限に活用し、新たな運動パターンの形成が促進されます【Stinear et al., 2007】。
これをアンマスキングといいます。(隠されていたものが顕在化する)
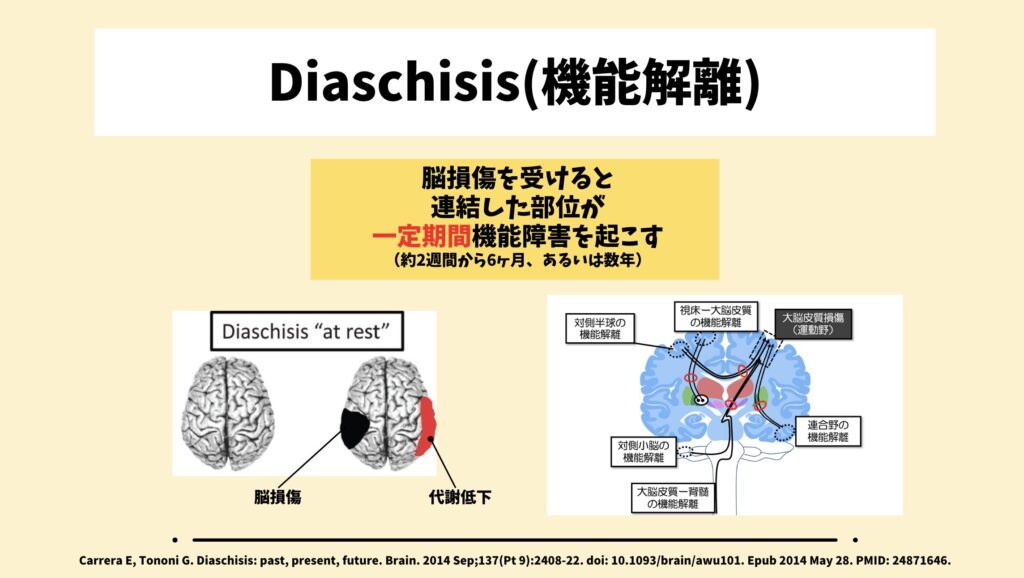
• ディアスキシス(機能乖離)からの解放: 脳卒中や外傷による脳損傷後に生じる神経学的現象で、損傷部位とは異なる遠隔部位における神経機能の一時的な低下や抑制を指します。この現象は、損傷された領域が他の脳領域と機能的に連結しているため、損傷部位からの影響が広がることで生じます。ディアスキシスは、初期の機能低下を引き起こし、機能回復の過程においても重要な役割を果たします。ディアスキシスは、以下のメカニズムによって引き起こされます:
遠隔部位の抑制: 脳のある領域が損傷を受けると、その領域と機能的に結びついた他の領域が活動を低下させます。これは、損傷部位からの興奮性入力が途絶えることや、抑制性入力が増加することによって起こります。特に、脳の一側の損傷が反対側の半球に影響を与えることがあります【Feeney & Baron, 1986】。
血流や代謝の低下: 損傷部位の周辺や遠隔部位において、血流や代謝が一時的に低下することもディアスキシスの要因となります。この現象は、脳全体の活動レベルに影響を及ぼし、損傷された領域とその周辺部位の機能が一時的に低下することがあります【von Monakow, 1914】。
このディアスキシスからの解放には数日〜長いと2年かかったという報告もあります。
皮質脊髄路の損傷の判別方法
皮質脊髄路の損傷を正確に評価するためには、以下の方法が広く用いられています。
- 磁気共鳴画像(MRI) • T1/T2強調画像: 脳や脊髄の解剖学的構造を評価し、出血や浮腫、壊死などの異常を確認します。
そのうち拡散強調画像(DWI)は急性期の脳卒中での損傷部位を特定するために用いられ、皮質脊髄路の急性期損傷はDWIで高信号として描出されることが多いです【Sakurai et al., 2012】。 - 拡散テンソル画像(DTI) • 拡散テンソルトラクトグラフィー(DTT): DTIは神経線維の方向や統合性を評価するために用いられ、皮質脊髄路の損傷がある場合、DTTで神経線維の途絶や異常が可視化されます【Schlaug et al., 1997】。
FA値(Fractional Anisotropy)の低下は、皮質脊髄路の損傷や脱髄を示唆し、損傷の重症度を評価するのに役立ちます【Thiebaut de Schotten et al., 2011】。 - 電気生理学的検査 • 運動誘発電位(MEP): 経頭蓋磁気刺激(TMS)を使用して、大脳皮質を刺激し、筋肉からの応答を記録します。MEPの遅延や消失は、皮質脊髄路の損傷を示唆します【Rossini et al., 1994】。
- 2点識別検査 • 2点識別覚の評価: 皮膚に2つの刺激を与え、それを1つとして感じるか2つとして感じるかを評価する検査です。この検査により、皮質脊髄路や体性感覚路の損傷の程度を把握することが可能です【Weinstein, 1968】
臨床応用とリハビリテーション
皮質脊髄路の損傷後のリハビリテーションは、神経可塑性を最大限に活用し、残存機能を強化することが目標です。これには、特定のトレーニング方法や技術が用いられます。以下では、リハビリテーションにおける具体的な手法とその効果について詳しく説明します。
運動イメージトレーニング
運動イメージトレーニングは、患者が実際に運動を行わなくても、脳内でその動作をイメージすることで皮質脊髄路を活性化させる手法です。このトレーニングは、脳の運動領域を刺激し、神経回路の再編成を促進します。運動イメージトレーニングが脳卒中後の運動機能回復に有効であることが、多くの研究で示されています【Sharma et al., 2006】。
機能的電気刺激(FES)
機能的電気刺激(FES)は、筋肉に電気刺激を与えることで、運動機能を促進する方法です。特に脳卒中後の患者において、FESは麻痺した筋肉の再活性化を助け、日常生活動作の改善に寄与します。この技術は、神経回路を活性化させると同時に、皮質脊髄路を介した信号伝達を強化する役割を果たします【Popovic et al., 2009】。
課題指向型トレーニング(Task-Oriented Training)
課題指向型トレーニング(Task-Oriented Training)は、具体的な動作や課題を繰り返し行うことで、運動機能を向上させる手法です。このトレーニングは、現実的な動作をシミュレートし、皮質脊髄路を含む神経ネットワークの再構築を促進します。研究によると、課題指向型トレーニングは脳卒中後の上肢機能の回復に効果的であり、運動パフォーマンスを向上させることが示されています【Langhorne et al., 2009】。
鏡像療法(Mirror Therapy)
鏡像療法(Mirror Therapy)は、患者が健康な側の動きを鏡で観察し、その動きを麻痺側に反映させることで、脳の運動野を活性化させる手法です。この療法は、特に上肢のリハビリテーションにおいて有効であり、麻痺側の運動機能の回復を促進します。研究によれば、鏡像療法と課題指向型トレーニングを組み合わせることで、効果がさらに高まることが報告されています【Ramachandran & Altschuler, 2009】。
機能回復のメカニズムに則った介入の考え方
皮質脊髄路の損傷後の機能回復は、単にリハビリテーションを行うだけでなく、損傷後の脳と脊髄の適応を理解し、そのプロセスを支援することが重要です。以下に、機能回復に関連する主要なメカニズムを挙げます。
神経回路の再編成
神経回路の再編成は、損傷を受けた皮質脊髄路の機能を他の神経経路が代償するプロセスです。このプロセスでは、未損傷の神経回路が新たなシナプスを形成し、運動機能の一部を引き継ぎます。これは、特に外側皮質脊髄路の損傷が重度である場合に重要な役割を果たします。神経回路の再編成は、長期的なリハビリテーションの成功に不可欠であり、適切なリハビリテーションプログラムの選定が求められます【Nudo, 2013】。
神経栄養因子の役割
神経栄養因子は、神経細胞の生存、成長、分化を支援する分子であり、神経回路の再編成を促進する役割を果たします。脳卒中後には、特に脳由来神経栄養因子(BDNF)などが増加し、神経可塑性を支援することが示されています。リハビリテーションを通じてこれらの因子の分泌が促進されることで、損傷後の機能回復が加速します【Keifer & Summers, 2016】。
残存機能の活用
残存機能の活用は、リハビリテーションにおける重要な戦略です。皮質脊髄路の一部が損傷を受けても、非損傷部分や他の神経経路が残存している場合、それらを最大限に活用することで、機能回復を図ります。特に非交叉の前皮質脊髄路や他の脊髄経路が代償的に利用されることが多く、この活用が機能回復に寄与します【Stinear et al., 2007】。
まとめと今後の展望
皮質脊髄路は、運動機能の制御とリハビリテーションにおいて極めて重要な役割を果たします。
その解剖学的構造や神経生理学的機能を深く理解することは、リハビリテーションの効果を最大化し、患者の運動機能回復を支援するために不可欠です。
未だわかっていないことも多々あります。日々新しい情報が出てくる中ではありますが、ある程度決まったことは理解しておくことが重要です。
最後までありがとうございました!
参考文献
Nudo, R. J. (2013). Recovery after brain injury: mechanisms and principles. Frontiers in Human Neuroscience, 7, 887. https://doi.org/10.3389/fnhum.2013.00887
2. Galea, M. P., & Darian-Smith, I. (1997). Corticospinal projections from the primary motor cortex in the macaque monkey. Journal of Comparative Neurology, 381(3), 282-296. https://doi.org/10.1002/(SICI)1096-9861(19970526)381:3<282::AID-CNE2>3.0.CO;2-2
3. Lemon, R. N. (2008). Descending pathways in motor control. Annual Review of Neuroscience, 31, 195-218. https://doi.org/10.1146/annurev.neuro.31.060407.125547
4. Taub, E., Uswatte, G., & Pidikiti, R. (2006). Constraint-Induced Movement Therapy: a new family of techniques with broad application to physical rehabilitation—a clinical review. Journal of Rehabilitation Research & Development, 43(3), 259-270. https://doi.org/10.1682/JRRD.2005.06.0103
5. Stinear, C. M., Barber, P. A., Petoe, M., Anwar, S., & Byblow, W. D. (2007). The PREP algorithm predicts potential for upper limb recovery after stroke. Brain, 140(3), 834-846. https://doi.org/10.1093/brain/awx003
6. Popovic, D. B., Popovic, M. B., & Sinkjær, T. (2009). Neurorehabilitation of upper extremities in individuals with stroke and traumatic brain injury using functional electrical stimulation. Neuromodulation: Technology at the Neural Interface, 12(3), 200-208. https://doi.org/10.1111/j.1525-1403.2009.00217.x
7. Langhorne, P., Coupar, F., & Pollock, A. (2009). Motor recovery after stroke: a systematic review. The Lancet Neurology, 8(8), 741-754. https://doi.org/10.1016/S1474-4422(09)70150-4
8. Ramachandran, V. S., & Altschuler, E. L. (2009). The use of visual feedback, in particular mirror visual feedback, in restoring brain function. Brain, 132(7), 1693-1710. https://doi.org/10.1093/brain/awp135
9. Keifer, J., & Summers, C. H. (2016). Putting the “biology” back into “neurobiology”: The strength of diversity in animal model systems for neuroscience research. Frontiers in Systems Neuroscience, 10, 69. https://doi.org/10.3389/fnsys.2016.00069
10. Sakurai, Y., Takeuchi, S., & Sasaki, M. (2012). Diffusion-weighted imaging in cortical laminar necrosis after ischemic stroke: A report of two cases. Journal of Neuroradiology, 39(1), 48-50. https://doi.org/10.1016/j.neurad.2011.01.004
11. Schlaug, G., Siewert, B., Benfield, A., Edelman, R. R., & Warach, S. (1997). Time course of the apparent diffusion coefficient (ADC) abnormality in human stroke. Neurology, 49(1), 113-119. https://doi.org/10.1212/WNL.49.1.113
12. Thiebaut de Schotten, M., Ffytche, D. H., Bizzi, A., Dell’Acqua, F., Allin, M., Walshe, M., … & Catani, M. (2011). Atlasing location, asymmetry and inter-subject variability of white matter tracts in the human brain with MR diffusion tractography. Neuroimage, 54(1), 49-59. https://doi.org/10.1016/j.neuroimage.2010.07.055
13. Rossini, P. M., Barker, A. T., Berardelli, A., Caramia, M. D., Caruso, G., Cracco, R. Q., … & Tomberg, C. (1994). Non-invasive electrical and magnetic stimulation of the brain, spinal cord, roots and peripheral nerves: Basic principles and procedures for routine clinical application. Electroencephalography and Clinical Neurophysiology, 91(2), 79-92. https://doi.org/10.1016/0013-4694(94)90029-9
14. Weinstein, S. (1968). Intensive and extensive aspects of tactile sensitivity as a function of body part, sex, and laterality. In The skin senses (pp. 195-222).
15.Feeney, D. M., & Baron, J. C. (1986). Diaschisis. Stroke, 17(5), 817-830. https://doi.org/10.1161/01.STR.17.5.817
16. Cramer, S. C. (2008). Repairing the human brain after stroke: I. Mechanisms of spontaneous recovery. Annals of Neurology: Official Journal of the American Neurological Association and the Child Neurology Society, 63(3), 272-287. https://doi.org/10.1002/ana.21393
17. Carrera, E., & Tononi, G. (2014). Diaschisis: past, present, future. Brain, 137(9), 2408-2422. https://doi.org/10.1093/brain/awu101